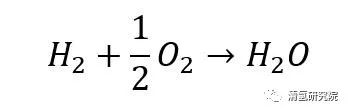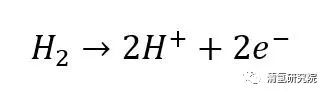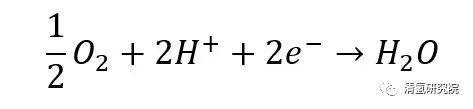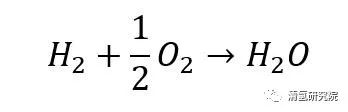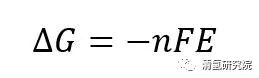|
氢燃料电池的基本概念与原理时间:2023-02-21 燃料电池(fuel cell)作为一种能量转换装置,能够以电化学反应的方式,等温地把贮存在燃料和氧化剂中的化学能直接转换为电能。本文我们将着重介绍以氢气或富氢气体为燃料的燃料电池——氢燃料电池。 1839年威廉·罗伯特·格罗夫发表首个关于“氢燃料电池”的研究报告——On Voltaic Series and the combination of gases by Platinum。报告指出,通过电解水逆反应实验装置在外接电路的电流计中检测到一定数值,即发生了氢气和氧气再重新组合,并在外电路中产生了电流。 这一过程的总反应为:
从总反应式来看,上述过程与氢气燃烧过程反应式非常“相似”。不同之处在于,燃料电池中的电化学反应不经过热机过程而直接产生电能,即无燃烧的明显特征——火焰。 对于氢燃料电池中的反应: 阳极反应:
阴极反应:
总反应:
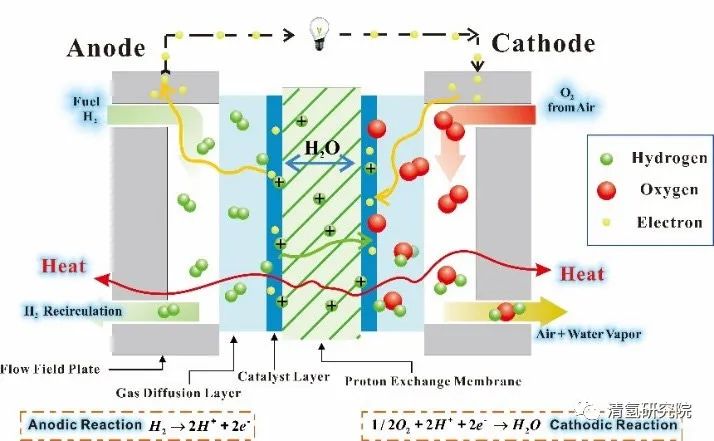
一个氢燃料电池单电池的构造组成和工作原理如图1所示。总体来看,一个氢燃料电池单电池由两侧的双极板(bipolar plate, BP)、以及由聚合物电解质膜(polymer electrolyte membrane/proton exchange membrane, PEM)、膜两侧的催化层(catalyst layer, CL)和气体扩散层(gas diffusion layer, GDL)构成的膜电极组件(membrane electrode assembly, MEA)共同组成。
图1:氢燃料电池工作原理示意图 来源:ResearchGate 反应物氢气和氧气(空气)通过双极板上的孔道被输送至膜电极处。在阳极侧,氢气在催化作用下被分解为带正电荷的氢离子和电子。其中氢离子可选择性通过质子交换膜,并在阴极侧在电催化剂作用下还原氧气生成纯净的水。即氢离子在将两个半反应分开的电解质内迁移,电子通过外电路定向流动、做功,形成总的电回路。氧化剂(氧气)发生还原反应的电极为阴极,其反应过程为阴极过程,对外电路依原电池定义为正极。还原剂或燃料(氢气)发生氧化反应的电极为阳极,其反应过程为阳极过程,对外电路为负极。 以H2/O2型质子交换膜燃料电池(proton exchange membrane fuel cell, PEMFC)为例。首先,在理想状态下,由化学热力学可知,在25℃,0.1MPa等温等压条件下的可逆电池反应中,向外所能做出的最大非膨胀功即电功为,
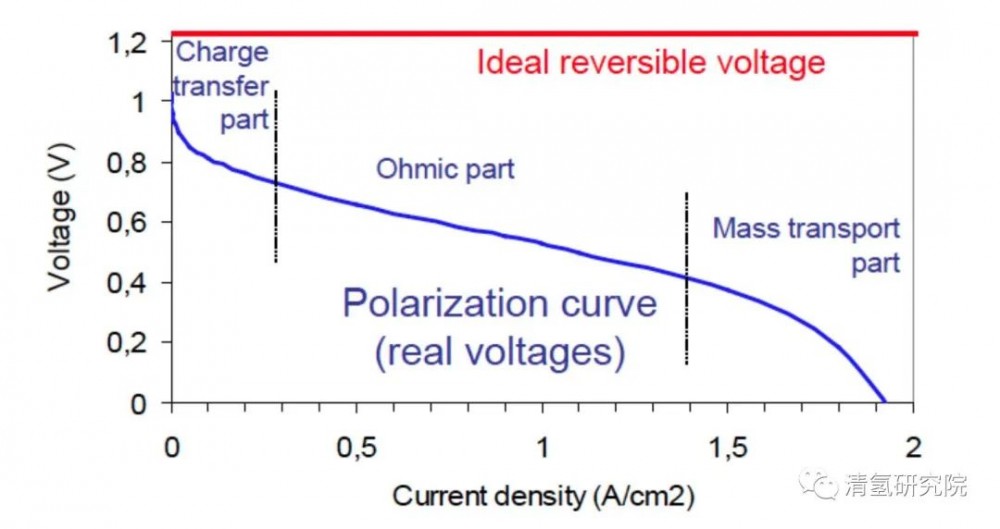
其中,ΔG为在该反应条件下生成液态水的反应吉布斯自由能变化,为-237.2kJ/mol;n为该反应中转移的电子数,为2;F为法拉第常数(=96485C);E为电池的可逆电动势。代入数据后计算得出,电池的可逆电动势(理论上的理想电动势,实际并不可行)为1.229V。 但在现实生活中,由于电化学反应中存在的各种极化限制*和热量损失等问题,燃料电池实际工作电压约在0.6~0.8V之间,其能量转化效率在40%~60%的范围内(以氢的高热值计算)。如果在冷却路中安装一个换热器把冷却液中的反应产生热量利用起来,用于供热供暖使用,实现热电联产,燃料电池的总利用率可提高至80%以上。该数值将会远远高于受限于卡诺循环的传统内燃机(其实际效率约为30%左右)。 *PEFMC的主要极化方式包括三种:1.由于电极表面上电化学反应动力学限制产生的动力学极化(kinetic loss);2.由燃料电池内部阻抗(impedance)引起的欧姆极化(Ohmic loss);3.由反应气体传质速度不能满足电极反应需要引起的传质极化(mass transport loss)。
图2:PEMFC典型的极化曲线 来源:参考文献 [1]W.R. Grove Esq. M.A. (1839) XXIV. On voltaic series and the combination of gases by platinum, The London, Edinburgh, and Dublin Philosophical Magazine and Journal of Science, 14:86-87, 127-130. [2]衣宝廉,俞红梅,侯中军等.氢燃料电池[M].北京:化学工业出版社,2021:3. [3]Larminie/Dicks: Fuel Cells Systems Explained, 2000, Wiley, 2000, ISBN 0-471-49026-1 [4]EG&G Services, Parsons Inc.: Fuel Cell Handbook(DE-AM26-99FT40575, 7th Edition, 2005) |